Agência FAPESP
02/02/2024
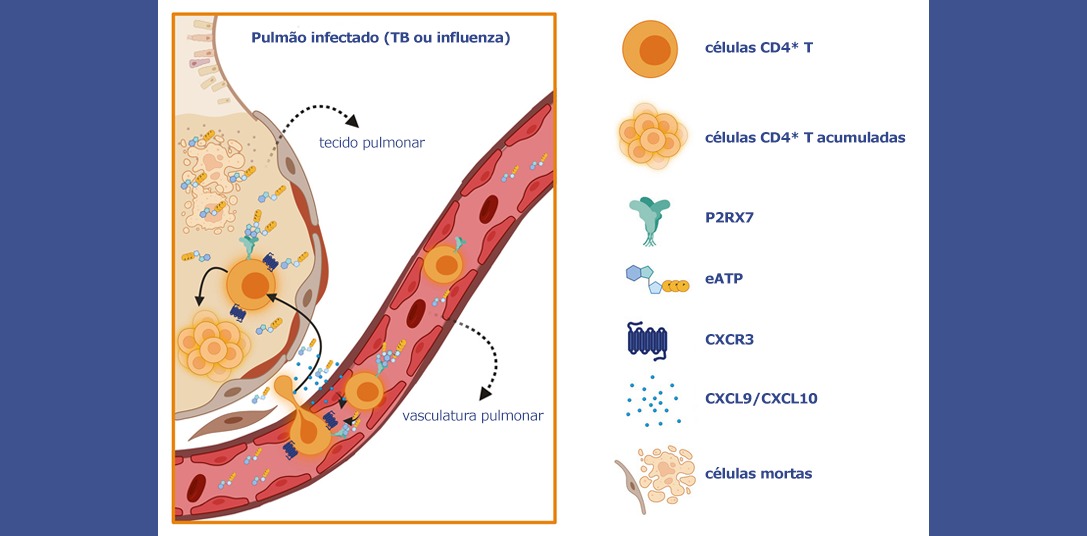
Luciana Constantino | Agência FAPESP – Os linfócitos T CD4+ já foram amplamente descritos na literatura científica pelo importante papel na resposta imunológica durante infecções pulmonares. Porém, pesquisa publicada na revista Cell Reports demonstrou que um acúmulo excessivo dessas células de defesa nos tecidos pulmonares – responsáveis pelas trocas gasosas essenciais para a respiração – está associado a danos nos pulmões em vez de desempenhar uma função de proteção.
A descoberta, obtida por meio de modelos de camundongos com tuberculose virulenta e influenza, aponta para a presença de uma “quantidade ideal” dos linfócitos no tecido pulmonar a fim de assegurar o bom desfecho da doença. Esse achado abre perspectivas para intervenções terapêuticas que visam reduzir o impacto no hospedeiro sem afetar a capacidade do sistema imunológico de combater a infecção. Mesmo números reduzidos de células T CD4+ no pulmão se mostraram suficientes para proteger contra a tuberculose, por exemplo.
Os pesquisadores observaram que o acúmulo dos linfócitos no tecido pulmonar é mediado por um tipo específico de receptor, o P2RX7, capaz de detectar a presença de ATP (sigla em inglês para trifosfato de adenosina) extracelular. O ATP tem função energética para a célula, mas em contextos de estresse ou dano tecidual é liberado no meio exterior, atuando como um sinal de perigo para as células de defesa e, em alguns casos, induzindo uma resposta excessiva.
O P2RX7 induz o acúmulo excessivo dos linfócitos, aumentando a expressão de CXCR3, um receptor de quimiocinas (proteínas que atuam como sinais químicos no sistema imunológico atraindo células específicas para áreas onde são necessárias). Segundo o estudo, o acúmulo de T CD4+ no pulmão induzido pela ativação do P2RX7 está ligado ao agravamento da patologia e à redução da sobrevida dos animais.
“Quando esse ATP está no meio extracelular, ele é reconhecido como um sinal de dano pelo sistema imune, já que a molécula que deveria estar dentro da célula saiu. Estudos vinham mostrando a importância dele para o desenvolvimento de formas graves da tuberculose, mas ainda não se sabia quais eram os mecanismos e especificamente qual célula mais expressava. Partimos daí para a pesquisa, porém, sempre tivemos a intenção de melhorar a resposta dessa célula. O que não esperávamos era que, se tirássemos o receptor bloqueando o reconhecimento do ATP, haveria uma melhora e não piora”, conta à Agência FAPESP o doutor em imunologia Igor Santiago-Carvalho, do Instituto de Ciências Biomédicas da Universidade de São Paulo (ICB-USP).
Primeiro autor do artigo, Santiago-Carvalho trabalhou sob a orientação da professora Maria Regina D’Império Lima, que vem pesquisando imunologia celular, principalmente em malária, doença de Chagas e tuberculose, há mais de 20 anos. “Quanto mais conseguirmos compreender quais são os principais ‘jogadores’ no balanço entre uma resposta imune deficitária, uma ótima e uma excessiva, maior será a chance de manipular essa resposta por meio de drogas e tratamentos visando um melhor controle e desfecho da doença”, afirma Lima.
De acordo com a professora, os linfócitos T são players importantes nesse processo pela capacidade de estimular e regular a resposta imune. “Por isso, buscamos entender quais são as vias de sinalização que influenciam esse balanço. Percebemos durante o projeto que, quando o tecido está muito danificado, acaba liberando uma grande quantidade de sinais de dano. Nos preocupamos particularmente com o ATP e vimos que a quantidade de linfócitos T que entra no tecido ao detectar essa molécula foi excessiva, induzindo uma resposta inflamatória intensa e lesiva. Em alguns casos, chega a levar a um processo fibrótico no pulmão. Interferir nessa via de sinalização pode ser interessante para reduzir os danos causados pela resposta imune excessiva contra a infecção”, completa.
O trabalho recebeu apoio da FAPESP por meio de um Projeto Temático concedido a Lima, além de uma Bolsa de Doutorado Direto para Santiago-Carvalho.
Gravidade
A tuberculose ainda é considerada um importante problema de saúde pública, agravada recentemente pelo aparecimento de bactérias resistentes a antibióticos. Infecciosa e transmissível, a doença afeta prioritariamente os pulmões.
Os sintomas mais comuns são tosse seca contínua, que depois de quatro semanas pode ter secreção; cansaço excessivo; febre baixa; sudorese noturna; falta de apetite; e emagrecimento acentuado.
O atraso no início do tratamento, a alta virulência das cepas e a suscetibilidade do paciente contribuem para a severidade do caso, frequentemente associada a uma resposta inflamatória deletéria, conduzindo à dificuldade de respiração e até necrose pulmonar. O tratamento é feito à base de antibióticos durante seis meses, não podendo haver abandono nem irregularidade.
No mundo, os novos casos diagnosticados de tuberculose foram recorde em 2022, com 7,5 milhões de registros, o que representa o maior número desde que a Organização Mundial da Saúde (OMS) iniciou o monitoramento global em 1995. O crescimento foi atribuído à ampliação dos serviços de diagnóstico e tratamento.
Futuro
Inicialmente projetado para trabalhar com tuberculose, o estudo também testou o papel do P2RX7 específico para T CD4+ em camundongos infectados com influenza. O resultado foi semelhante.
“Isso direcionou bastante o que estou fazendo ao continuar estudando como sinais de dano controlam as respostas imunes. No artigo, chegamos à conclusão de que as células T CD4+ podem ser patogênicas. Agora queremos entender o que leva ao aumento dessa patogenia para, assim, defini-la e mostrar os mecanismos por trás disso, podendo aplicá-los para outras doenças. Entendendo as características dessa célula que acabam induzindo uma resposta tão forte a ponto de danificar o tecido é possível buscar alternativas terapêuticas”, explica Santiago-Carvalho.
Atualmente, ele está no Departamento de Imunologia da Mayo Clinic (Estados Unidos), trabalhando no laboratório do pesquisador Henrique Borges da Silva, coautor do estudo.
O artigo T cell-specific P2RX7 favors lung parenchymal CD4+ T cell accumulation in response to severe lung infections pode ser lido em: www.cell.com/cell-reports/fulltext/S2211-1247(23)01460-2#%20.
Como citar este texto: Agência FAPESP. Estudo revela mecanismo que agrava tuberculose e reduz sobrevida. Texto de Luciana Constantino. Saense. https://saense.com.br/2024/02/estudo-revela-mecanismo-que-agrava-tuberculose-e-reduz-sobrevida/. Publicado em 02 de fevereiro (2024).


